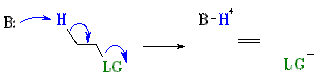1. Senyawa alifatik
Senyawa hidrokarbon alifatik ini adalah senyawa yang mengandung unsur karbon dan hydrogen saja. Senyawa hidrokarbon alifatik ada tiga yaitu alkana alkuna dan alkena yang biasanya dimulai dari metana maupun etena dan etuna. pemanfaaatan dalam kehidupan sehari - hari sering kita rasakan contohnya untuk alkana terdapat gas elpiji yang komposisinya yaitu gas propana (C3H8) dan butana (C4H10) 99 % serta sisanya gas pentana (C5H12) yang dicairkan.
2. Senyawa Alisiklik
Senyawa alisiklik pada dasarnya merupakan senyawa alifatik namun dengan struktur cincin yang terbentuk dari ikatan tunggal antar dua atom karbon. Pemanfaatan dalam kehidupan sehari – hari salah satunya adalah sikloheksana yang digunakan sebagai pelarut nonpolar dalam perindustrian kimia serta bahan dasar dalam pembuatan nilon yaitu asam adipat dan kaprolaktam.
3. Aldehida
Hidrokarbon dengan gugus O pada salah satu ikatan rangkap rantai karbon dan H pada saah satu rantai karbonnya. Pemanfaatan dalam kehidupan salah satunya formaldehida (H₂CO) dalam bentuk gas, formalin dalam bentuk cair, paraformaldehyde atau trioxane dalam bentuk padat, biasanya digunakan sebagai disinfektan dalam bidang pertanian pembersih lantai, kapal, gudang dan pakaian dalam kehidupan sehari – hari, pengawet dalam vaksinasi serta pengangkatan kutil dalam dunia medis.
4. Keton
Hidrokarbon dengan gugus O pada salah satu ikatan rangkap rantai karbonnya (C = O). Pemanfaatannya dalam kehidupan yaitu Fruktosa dan gula lainnya sebagai sumber gizi sebagai karbohidrat.
5. Alkohol
Hidrokarbon dengan gugus OH yang terkait pada rantai karbon secara langsung. Alkohol di bagi atas ukuran molekularnya, pemanfaatannya diantaranya sebagai pelarut hal ini dikarena polaritas yang tinggi namun dikarenakan factor volatilitas tidak semuanya bisa digunakan sebagai pelarut. Lalu ada etanol sebagai minuman beralkohol dan disinfektan.
6. Ester
Hidrokarbon dengan satu gugus hidroksil (OH) digantikan dengan guus alkoksi (O-alkil) dan biasanya diturunkan dari asam karboksilat dan alcohol. Pemanfaatannya dalam kehidupan sehari – hari adalah sebagai minyak wangi, esen aroma, seperti esen aroma pisang yaitu isoamil asetat.
7. Eter
Senyawa dengan dua hidrokarbon yang sama maupun berbeda. Mereka adalah senyawa yang memiliki bau yang banyak. Eter biasanya stabil dan tidak bereaksi baik pada reduktor maupun oksidator serta asam maupun basa terkecuali pada suhu yang tinggi, hal ini lah yang menyebabkan eter sering digunakan sebagai pelarut organic, lalu sebagai anestetik, pembuatan lemak, lilin dan zat lain yang susah larut dalam air.
8. Asam lemak
Ester terurai menjadi asam lemak dan alcohol dengan struktur –COOH dan biasanya ditemukan dalam kehidupan sehari –hari sebagai bahan untuk membuat sabun.
9. Amina
Amina merupakan turunan amonia dengan satu atau lebih hydrogen diganti oleh gugus alkil. Pada amina mengandung nitrogen pada gugus amino yang terikat pada satu hingga tiga karbon. Manfaat amina dalam kehidupan sehari – hari salah satunya adalah efedrina sebagai peluruh dahak.
10. Amida
Amida merupakan turunan asam karboksilat dengan gugus karboksil digantikan dengan –NH2 , gugus R berupa hidrogen atau alkil maupun aril radikal. Dalam kehidupan sehari – hari biasanya digunakan sebagai obat – obatan seperti sulfoamida sebagai pencegah infeksi.
11. Asam Amino
Senyawa organik yang menyusun protein. Asam amino mengandung gugus amino (NH2), gugus asam karboksilat (COOH), dan satu gugus lain. Asam amino banyak ditemukan dalam tubuh dalam bentuk protein sabagai zat yang mengatur metabolism tubuh.
12. Senyawa aromatik
Senyawa hidrokarbon dengan ikatan tunggal dan ikatan rangkap pada gugus karbon berbentuk siklik namun tidak jenuh, dan biasanya memiliki aroma yang khas. Biasanya digunakan sebagai pemanis buatan seperti sakarin, pengawet, pewarna makanan.
13. Steroid
senyawa dengan struktur triterpena asiklik yang memiliki empat cincin dimana cincin 3 merupakan sikloheksana dan sisanya merupakan siklopentana. Biasanya sebagai bahan penyusun kolesterol dan struktur lainnya yang berasal dari lipid. Biasanya sebagai penguat tubuh, obat-obatan seperti betametason.
14. Asam organik
asam organic tersusun atas gugus karbonil dan hidroksil atau biasa disebut gugus karboksil. Gugus yang terikat pada karboksil dapat berupa gugus apapun bahkan dapat berupa karboksil lainnya. Lain halnya dengan asam anorganik yang cair justru asam organic bersifat padat dan tidak sekuat asam anorganik. Dalam kehidupan sehari – hari asam organic yang sering digunakan yaitu asam asetat dalam bidang perdagangan, industry maupun labolatorium seperti halnya cuka yang merupakan larutan 3-6% asam asetat dalam air, asam oksalat sebagai penghilang karat, pembuatan warna, asam tratat sebagai pengasaman minuman, dan permen.
15. Alkil halida
Senyawa dengan halogen yang terikat dengan atom karbon jenuh yang terhibridisasi sp3. Biasanya digunakan sebagai senyawa antara sintetis dalam labolatorium, bahan pembersih, bahan untuk mendinginkan kulit pada daerah tropis.
Stereokimia Lanjutan
Senyawa organik adalah senyawa yang memiliki unsur karbon di dalamnya. Bahan kimia dan reaksi, mereka unik untuk bahan kimia lainnya. Beberapa dari mereka
Perbedaan struktur 3 dimensi suatu molekul walaupun memiliki rumus molekul yang sama akan berdampak pada kegunaan yang berbeda pula berupa rasemat yaitu produk isomer dengan struktur yang berlawanan
a. Isomer geometri alifatik
Pada alkena isomer geometrinya ada cis dan trans, terjadinya isomer ini dikarenakan ketegaran dalam molekul. Pada senyawa alkena alifatik maupun siklik, ikatan pi harus dipatahkan untuk memutar ikatan rangkap sebagai sumbunya, hal ini dikarenakan gugus yang terikat pada ikatan pi memiliki posisi yang tetap antar ruang satu dengan yang lainnya, dengan syarat gugus yang diikat haruslah berbeda.
Dalam penulisan sistem tata nama isomer geometri selain aturan cis dan trans juga terdapat aturan E (entgegen) untuk posisi berlawanan dan Z (Zussamen) untuk posisi yang sama, hal ini dibuat untuk memudahkan dalam mengurutkan nomor pada subtituen yang lebih dari dua.
b. Isomer geometri siklik
Isomer geometri siklik salah satunya adalah sikloalkana yang memiliki beberapa sifat kimia yang sama dengan alkana asiklik seperti non polar serta inert, namun alkane siklik lebih fleksibel dari pada sikloalkana. ikatan sigma pada sikloalkana kurang fleksibel untuk berputar dari pada alkana siklik, sehingga ketika berputar pasti akan merusak cincin. Dalam melakukan isomerase sikloalkana dilakukan berdasarkan letak subtituennya hal ini dikarenakan sisi atas dan bawah pada sikloalkana menjadi titik acuan.
permasalahan
1. Bagaimanakah cara kerja formalin sebagai pengawet?
2. Mengapa asam lemak tak jenuh dengan isomer cis justru memiliki manfaat besar bagi kesehatan tubuh kita dibandingkan dengan asam lemak tak jenuh isomer trans?
3. Bagaimanakah cara kerja sabun dalam membersihkan kotoran?
Jumat, 30 Agustus 2019
Senin, 19 Agustus 2019
Konformasi Struktur
Isomer konformasi adalah
terjadinya suatu rotasi disekitar ikatan tunggal pada hibridisasi Csp3
baik pada senyawa alkana alifatik maupun siklik sehingga membentuk isomer
dengan struktur molekul dan orientasi ruang yang berbeda. Perbedaan tingkat
energy pada isomer menyebabkan terjadinya kestabilan sementara molekul,
mekanisme maupun hasil reaksi berpengaruh, sebagai akibat dari Csp3
– Csp3 yang salaing berotasi. Pada suhu kamar senyawa dengan isomer
konformasi tidak bisa dibedakan namun pada hakikatnya tetap memiliki perbedaan
pada sifat fisik maupun kimia. Perubahan bentuk konformasi menjadi bentuk lain
tidak akan merusak ikatan kimianya.
Isomer konformasi senyawa alkana alifatik
Jika ikatan sigma pada atom C yang
berikatan dengan hibridisasi Csp3 – Csp3 membentuk sudut
putar 60o, maka akan membentuk konformasi staggered yang memiliki energi lebih rendah dari konformasi eclipsed, yang mana atom hidrogen pada
konformasi staggered akan membentuk
sudut 60o sedangkan pada konformasi eclipsed akan saling menyelaraskan membentuk sudut 0o,
sehingga akan membentuk perbedaan tingkat energi
Isomer konformasi senyawa alkana siklik
Menurut von baeyer alkana siklik berbentuk
planar dengan ikatan siklo yang lebih kecil akan lebih stabil dari pada ikatan
siklo yang lebih besar, namun pada kenyataannya hal tersebut tidaklah benar. Menurut
von baeyer perbedaan kestabilan disebabkan ketegangan sudut atau cincin sebagai
hasil dari penyimpangan sudut hibridisasi Csp3 tetrahedral.
sikloalkana
|
Ukuran cincin (n)
|
∆HC (KJ/mol)
|
∆HC per CH2-
|
(KJ/mol)
|
Total energi strain
|
|
Cincin strain
|
Skiloporpana
|
3
|
2091
|
697
|
(43)
|
129
|
Siklobutana
|
4
|
2721
|
681
|
(27)
|
108
|
|
Cincin biasa
|
Siklopentana
|
5
|
3291
|
658
|
(4)
|
20
|
Sikloheksana
|
6
|
3920
|
654
|
(0)
|
0
|
|
Sikloheptana
|
7
|
4599
|
657
|
(3)
|
21
|
|
Cincin sedang
|
Siklooktana
|
8
|
5267
|
658
|
(4)
|
32
|
Siklononana
|
9
|
5933
|
659
|
(5)
|
45
|
|
Siklodekana
|
10
|
6587
|
659
|
(5)
|
45
|
|
Cincin lebar
|
Sikloheksadekana
|
16
|
10466
|
654
|
(0)
|
0
|
Keterangan alkana
|
654
|
0
|
||||
Penghitungan data strain untuk senyawa
sikloalkana dapat dihitung dari data panas pembakaran dengan cara menambahkan
gugus CH2 pada sikloalkana dan akan terjadi kenaikan panas
pembakaran seiring bertambahnya gugus CH2 yang ditambahkan hal ini
disebabkan senyawa sikloalkana dengan struktur molekul yang semakin tegang akan
menghasilkan panas berlebih.
Permasalahan
1. Bagaimanakah bentuk isomer konformasi pada butana?
2. Mengapa cincin pada alkana siklik yang lebih kecil akan kurang stabil daripada cincin yang lebih besar?
3. Mengapa sikloheksana dalam bentuk kursi adalah bentuk yang paling satbil?
Permasalahan
1. Bagaimanakah bentuk isomer konformasi pada butana?
2. Mengapa cincin pada alkana siklik yang lebih kecil akan kurang stabil daripada cincin yang lebih besar?
3. Mengapa sikloheksana dalam bentuk kursi adalah bentuk yang paling satbil?
Sabtu, 09 Maret 2019
Mekanisme reaksi bersaing SN2 dan E2
Pada reaksi SN2 dan reaksi E2 terjadi
pada pelarut non polar dengan nukelofil berupada basa lewis kuat seperti -OH,
-OR, -CN, adanya kesamaan faktor terjadinya kedua reaksi
tersebut maka timbul persaingan diantara keduanya, namun seperti pada
pembehasan sebelumnya reaksi subtitusilah yang lebih dominan dari pada reaksi
eliminasi begitu pula dalam bahasan kali ini reaksi SN2 lebih
dominan daripada E2, hal ini dikarenakan suasana yang kurang basa, namun
apabila suasana pada tingkat kebasaan yang tinggi maka akan lebih dominan
terjadinya reaksi E2.
Jika Nukelofilnya menyerang atom karbon pusat maka
akan terjadi reaksi SN2 namun apabila yang diserang atom hidrogen
pada tangan yang terikat oleh atom karbon paling ujung (H-β) maka yang terjadi
reaksi E2, untuk lebih jelasnya dapat dilihat pada reaksi dibawah ini:
Berikut
adalah faktor yang mempengaruhi terjadi persaingan SN2 dan E2:
1. Struktur
Substrat (alkil halida)
a.
Apabila alkil halida yang digunakan
berupa alkil halida primer maka akan lebih dominan terjadinya reaksi SN2
ketimbang E2, hal ini dikarenakan sterik pada alkil halida primer lebih rendah jadi
akan lebih dominan reaksi SN2. Contoh:
Terjadinya
persaingan itu sendiri tidak jauh kaitannya dengan sterik apabila didalam alkil
halida primer memiliki subtituen pada karbon-β, maka nukelofil akan lebih
dominan menyerang subtituen daripada karbon pusat (karbon-α), hal inilah yang
menyebabkan terjadinya persaingan dan reaksi E1 akan lebih dominan terjadi.
b. Apabila
alkil halida yang digunakan berupa alkil halida skunder maka akan terbentuk produk
substitusi dan eliminasi. Kuantitas daripada keduanya bergantung pada kekuatan
basa dan banyaknya nukleofil. Kekuatan dan kuantitas basa, maka makin banyak
pula produk eliminasi yang terbentuk. Seperti halnya asam asetat (pKa
= 4,76) adalah asam yang lebih kuat ketimbang etanol (pKa = 15,9), maka
ion yang terbentuk pada asam asetat tingkat kebasaannya akan lebih lemah
daripada ion yang terbentuk pada etanol (etoksida). Pada basa yang lemah akan
terbentuk reaksi subtitusi SN1 begitupula sebaliknya.
c. Apabila
alkil halida yang digunakan berupa alkil halida tersier maka reaksi eliminasi akan
lebih dominan daripada reaksi substitusi, hal ini dikarenakan kereaktifan yang lebih
dominan terjadi pada reaksi E2 hal itu disebabkan karena halngan sterik yang
sangat kuat sehingga nukelofil akan lebih dominan menyerang subtituen pada
karbon-β ketimbang atom karbon pusatnya (karbon-α). Contoh:
2. Struktur
Nukleofil
Banyaknya ion basa kuat (ters-butoksida) akan
mempengaruhi banyaknya reaksi Eliminasi yang terjadi,
dapat kita lihat pada reaksi berikut ini:
Pada reaksi dengan ion basa kuat (tersier) maka akan lebih
dominan terbentuk produk eliminasi begitupula sebaliknya hal ini dikarenakan
ketidakmampuan ion basa tersier dalam menarik hidrogen internal, dikarenakan
pada ion basa tersier lebih cenderung menolak dikarenakan halangan steriknya
yang besar ketimbang menarik.
3. Temperatur
Semakin tinggi suhunya maka reaksi SN2
mapun E2 akan lebh mudah terjadi, namun pada reaksi eliminasi laju raskinya akan lebih besar dikarenakan energi
aktivasinya yang lebih tinggi,
sehingga
temperatur yang tinggi itulah yang memungkinkan molekul akan lebih dominan
untuk mencapai kondisi transisi pada reaksi eliminasi.
Permasalahan- Apa perbedaan antara reaksi SN2 dan E2?
- Bagaimana reaksi E2 dapat bersaing dengan SN2?
- Apakah mungkin pada reaksi SN2 dan E2 terjadi pada pelarut polar? Jika tidak maupun iya berikan alasannya!
Sabtu, 02 Maret 2019
Mekanisme reaksi bersaing SN1 dan E1
Reaksi SN1
Tahapan
Reaksi E1
Tahapan
Pada kedua reaksi tersebut kecepatan reaksi ditentukan pada tahapan ionisasi yang membentuk karbokation yang lebih stabil, hal ini membutuhkan energi yang lebih sedikit, semakin stabil substartnya (alkil halida tersier) maka tolakan sterik yang ditimbulkan semakin besar yang menyebabkan karbokation dan gugus pergi terlepas.
Persaingan terjadi pada saat tahap kedua, Nukelofil yang merupakan basa bronsted lowry lemah dapat menyerang karbokation (reaksi SN1) atau justru mengalami deprotonasi dengan menerima proton dari atom H serta membentuk alkena (reaksi E1). Apabila reaksi dijalankan pada suhu yang tinggi maka reaksi E1 akan berjalan lebih dominan dari pada SN1 lalu yang kedua untuk nukelofil yang digunakan, pada reaksi E1 menggunakan basa bronsted loswry yang lebih lemah daripada SN1, dikarenakan pada reaksi E1 nukelofil nantinya akan mendapatkan donor proton dari atom H sedangkan pada reaksi SN1 akan langsung berikatan dan pada akhirnya akan melepaskan kelebihan proton. Lalu yang ketiga adalah struktur karbokation, semakin stabil karbokationnya atom H didalamnya akan lebih sukar untuk mendonorkan proton kepada nukleofil serta membentuk alkena ketimbang karbokation itu sendiri langsung berikatan dengan nukleofil.
Kesimpulannya reaksi SN1 Bereaksi lebih dominan dari pada reaksi E1 dikarenakan pada reaksi SN1 tidak memerlukan suhu yang relatif tinggi, bisa terjadi pada basa lemah dengan tingkat kelemahan apapun walupun pada tingkat kelemahan yang lebih rendah akan cenderung berlaku reaksi E1 namun pada keseluruhan reaksi SN1 lebih dominan, lalu ada struktur karbokation yang lebih cenderung untuk langsung berikatan dengan nukelofil, serta tahapan pada SN1 yang lebih cepat walaupun banyaknya tahapan lebih banyak pada reaksi SN1 namun pada tahapan akhir reaksi SN1 hanya melepaskan kelebihan proton saja sedangkan pada reaksi E1 melakukan deprotonasi.
Permasalahan
Tahapan
- Proses ionisasi, pemisahan gugus pergi dari substart sehingga menghasilkan karbokation Guguspergi disebut senyawa antara, pada grafik energi sebagai titik tertinggi yang mampu bergerak maju menjadi produk ataupun berdegradasi menjadi substart.
- Penyerangan nukelofil, nukelofil menyerang karbokation sehingga terhibridisasi sp2 dan menghasilkan produk subtitusi
- Pelepasan proton
Reaksi E1
Tahapan
- Proses ionisasi, Proses ionisasi, pemisahan gugus pergi dari substart sehingga menghasilkan karbokation sama seperti SN1
- Proses deprotonasi, Pemberian proton kepada basa bronted lowry lemah serta pembentukan ikatan rangkap dua.
Pada kedua reaksi tersebut kecepatan reaksi ditentukan pada tahapan ionisasi yang membentuk karbokation yang lebih stabil, hal ini membutuhkan energi yang lebih sedikit, semakin stabil substartnya (alkil halida tersier) maka tolakan sterik yang ditimbulkan semakin besar yang menyebabkan karbokation dan gugus pergi terlepas.
Persaingan terjadi pada saat tahap kedua, Nukelofil yang merupakan basa bronsted lowry lemah dapat menyerang karbokation (reaksi SN1) atau justru mengalami deprotonasi dengan menerima proton dari atom H serta membentuk alkena (reaksi E1). Apabila reaksi dijalankan pada suhu yang tinggi maka reaksi E1 akan berjalan lebih dominan dari pada SN1 lalu yang kedua untuk nukelofil yang digunakan, pada reaksi E1 menggunakan basa bronsted loswry yang lebih lemah daripada SN1, dikarenakan pada reaksi E1 nukelofil nantinya akan mendapatkan donor proton dari atom H sedangkan pada reaksi SN1 akan langsung berikatan dan pada akhirnya akan melepaskan kelebihan proton. Lalu yang ketiga adalah struktur karbokation, semakin stabil karbokationnya atom H didalamnya akan lebih sukar untuk mendonorkan proton kepada nukleofil serta membentuk alkena ketimbang karbokation itu sendiri langsung berikatan dengan nukleofil.
Kesimpulannya reaksi SN1 Bereaksi lebih dominan dari pada reaksi E1 dikarenakan pada reaksi SN1 tidak memerlukan suhu yang relatif tinggi, bisa terjadi pada basa lemah dengan tingkat kelemahan apapun walupun pada tingkat kelemahan yang lebih rendah akan cenderung berlaku reaksi E1 namun pada keseluruhan reaksi SN1 lebih dominan, lalu ada struktur karbokation yang lebih cenderung untuk langsung berikatan dengan nukelofil, serta tahapan pada SN1 yang lebih cepat walaupun banyaknya tahapan lebih banyak pada reaksi SN1 namun pada tahapan akhir reaksi SN1 hanya melepaskan kelebihan proton saja sedangkan pada reaksi E1 melakukan deprotonasi.
Permasalahan
- Apa perbedaan reaksi SN1 dan E1?
- Mengapa lebih dominan terjadi reaksi SN1 dari pada E1?
- Apakah mungkin pada kedua reaksi tersebut dilakukan pada pelarut non polar? Berikan penjelasannya!
Kamis, 21 Februari 2019
Mekanisme Reaksi Eliminasi Unimolekuler (E1)
Mekanisme E1
Contoh khasnya adalah dehidrasi asam yang dikatalisisoleh alkohol 2o atau 3o.
Langkah 2:
Langkah 3:
MEKANISME E1 PADAALKIL HALIDA
Permasalahan :
E1 menyatakan suatu reaksi eliminasi unimolekular, di mana
laju reaksi = k [R-LG].
Ini menyatakan bahwa langkah penentuan laju reaksi
tergantung pada dekomposisi spesies molekuler tunggal.
Secara keseluruhan, jalur ini adalah proses banyak langkah
dengan dua langkah kritis berikut:
hilangnya gugs pergi, LG, untuk menghasilkan intermediet karbokation, kemudian
kehilangan proton, H +, dari karbokation untuk membentuk
ikatan π
Mari kita lihat bagaimana berbagai komponen reaksi
mempengaruhi jalur reaksi:
R-
Urutan reaktivitas: (CH3)3C-> (CH3)2CH->
CH3CH2-> CH3-
Dalam reaksi E1, langkah penentuan laju adalah hilangnya
gugus pergi membentuk intermediet karbokation. Semakin stabil karbokationnya,
semakin mudah terbentuk, dan semakin mempercepat reaksi E1. Terdapat beberapa
anggapan bahwasanya sistem dengan karbokation yang kurang stabil akan bereaksi
paling cepat, namun pada dasarnya turunan dari karbokationlah yang menentukan
laju reaksi. Karena intermediet karbokation terbentuk selama E1, selalu ada
kemungkinan penataan ulang (mis. 1,2-hidrida atau 1,2-alkil bergeser) untuk
menghasilkan karbokation yang lebih stabil. Ini biasanya ditunjukkan oleh
perubahan posisi alkena atau perubahan kerangka karbon produk bila dibandingkan
dengan substart.
-LG
Satu-satunya peristiwa yang menandakan terjadinya reaksi E1
adalah pemutusan ikatan C-LG. Oleh karena itu, ada ketergantungan yang sangat
kuat pada sifat gugus pergi, semakin baik gugus pergi, semakin cepat pula reaksi
E1. Dalam reaksi alkohol yang dikatalisis oleh asam, -OH diprotonasi terlebih
dahulu untuk memberikan ion oksonium, memberikan gugus pergi yang lebih baik, molekul air (lihat skema di bawah).
B
Karena basa tidak terlibat dalam langkah penentuan laju,
sifat basa tidak penting dalam reaksi E1. Namun, semakin reaktif basa, semakin
besar kemungkinan reaksi E2 menjadi.
Selektivitas
Reaksi E1 akan lebih berjalan dengan baik apabila alkena
yang menjadi produk utama lebih stabil: yaitu lebih tersubstitusi pada alkil
dan trans-> cis-
Jalur mekanisme E1 ini paling umum:
- Gugus pergi yang baik
- karbokation yang stabil
- basis yang lemah
Contoh khasnya adalah dehidrasi asam yang dikatalisisoleh alkohol 2o atau 3o.
MEKANISME E1 PADA ALKOHOL
Langkah 1:
Reaksi asam / basa. Protonasi oksigen yang beralkohol menhasilkan
gugus pergi yang baik. Langkah ini sangat cepat dan dapat dibalik. Pasangan
elektron bebas pada oksigen membuatnya menjadi basa Lewis. Mekanisme E1 untuk
ROH
Langkah 2:
Pembelahan ikatan C-O memungkinkan hilangnya gugus pergi
yang baik, molekul air yang netral, untuk memberikan intermediet karbokation.
Ini adalah langkah penentuan laju (pemutusan ikatan merupakan reaksi endotermik)
Langkah 3:
Reaksi asam / basa. Deprotonasi oleh suatu basa (molekul
air) dari atom C yang berdekatan dengan pusat karbokation mengarah pada pembentukan
C = C
MEKANISME E1 PADAALKIL HALIDA
Langkah 1:
Pembelahan ikatan C-X yang terpolarisasi memungkinkan hilangnya
gugus pergi yang baik, ion halida, untuk intermediet karbokation. Ini adalah
langkah penentuan laju (pemutusan ikatan adalah mekanisme E1 untuk RX)
Langkah 2:
Reaksi asam / basa. Deprotonasi oleh basa (di sini ion
alkoksida) dari atom C yang berdekatan dengan pusat karbokation mengarah pada pembentukan
C = C
Permasalahan :
- Apa perbedaan antara reaksi E1 dan E2?
- Hal apakah yang menyatakan bahwasanya reaksi E1 disebut reaksi eliminasi unimolekuler?
- Apakah mungkin pada reaksi eliminasi E1 dilakukan dalam pelarut non polar?
Sabtu, 16 Februari 2019
Mekanisme reaksi eliminasi E2
Mekanisme E2
E2 menggambarkan suatu reaksi eliminasi bimolekuler, dengan laju = k [B] [R-LG], yang berarati penentuan laju reaksi melibatkan dua spesi yaitu Basis (B), dan substrat organik (R-LG)
Tahapan ini adalah proses terpadu dengan karakteristik sebagai berikut:
secara bersamaan H+ terlepas dari substrat dengan diikutinya hilangnya gugus pergi Secara bersamaan reaksi pelepasan proton (H+) oleh Basis, terjadi pula pelepasan gugus pergi dan meninggalkan substrat serta membentuk formasi ikatan π
Berikut adalah berbagai komponen reaksi yang mempengaruhi jalannya suatu reaksi:
Efek dari R-
Urutan reaktivitas: (CH3) 3C-> (CH3) 2CH-> CH3CH2-> CH3-
Pada reaksi E2, 2 atom karbon sp3 dirubah menjadi atom karbon sp2. Hal Ini menggerakkan substituen terlepas lebih jauh sehingga mengurangi interaksi sterik. Jadi sistem yang lebih tersubstitusi mengalami eliminasi E2 lebih cepat. Ini adalah tren reaktivitas yang sama seperti yang terlihat pada reaksi E1.
-LG
Ikatan C-LG terputus selama tahap pembentukan nilai, sehingga nilainya tergantung pada sifat gugus pergi.
Namun, jika gugus pergi terlalu baik, maka reaksi E1 dapat terjadi.
B
Karena basa terlibat dalam langkah penentuan laju, sifat basa sangat penting dalam reaksi E2.
Lebih banyak basa reaktif akan mendukung reaksi E2.
Stereokimia
Reaksi E2 terjadi paling cepat ketika ikatan H-C dan ikatan C-LG yang terlibat adalah co-planar, kebanyakan 180o atau antiperiplanar. Hal Ini mengatur ikatan s yang terputus pada posisi yang benar untuk menjadi ikatan p.
Selektivitas
Pengaturan antiperiplanar dalam reaksi E2
Hasil reaksi E2 dikendalikan oleh persyaratan stereokimia yang dijelaskan di atas. Di mana ada pilihan, alkena yang lebih stabil akan menjadi produk utama.
Jalur E2 paling umum dengan:
Contoh khas adalah dehidrohalogenasi alkil halida menggunakan KOtBu / tBuOH.
Permasalahan
Jelaskanlah perbedaan antara reaksi eliminasi dengan substitusi?
Mengapa pada reaksi E2 nukleofil yang digunakan adalah basa bukannya asam?
Mengapa Reaksi Eliminasi 2 (E2) laju reaksi alkil halida tersier lebih cepat dibandingkan yang lainnya?
E2 menggambarkan suatu reaksi eliminasi bimolekuler, dengan laju = k [B] [R-LG], yang berarati penentuan laju reaksi melibatkan dua spesi yaitu Basis (B), dan substrat organik (R-LG)
Tahapan ini adalah proses terpadu dengan karakteristik sebagai berikut:
secara bersamaan H+ terlepas dari substrat dengan diikutinya hilangnya gugus pergi Secara bersamaan reaksi pelepasan proton (H+) oleh Basis, terjadi pula pelepasan gugus pergi dan meninggalkan substrat serta membentuk formasi ikatan π
Berikut adalah berbagai komponen reaksi yang mempengaruhi jalannya suatu reaksi:
Efek dari R-
Urutan reaktivitas: (CH3) 3C-> (CH3) 2CH-> CH3CH2-> CH3-
Pada reaksi E2, 2 atom karbon sp3 dirubah menjadi atom karbon sp2. Hal Ini menggerakkan substituen terlepas lebih jauh sehingga mengurangi interaksi sterik. Jadi sistem yang lebih tersubstitusi mengalami eliminasi E2 lebih cepat. Ini adalah tren reaktivitas yang sama seperti yang terlihat pada reaksi E1.
-LG
Ikatan C-LG terputus selama tahap pembentukan nilai, sehingga nilainya tergantung pada sifat gugus pergi.
Namun, jika gugus pergi terlalu baik, maka reaksi E1 dapat terjadi.
B
Karena basa terlibat dalam langkah penentuan laju, sifat basa sangat penting dalam reaksi E2.
Lebih banyak basa reaktif akan mendukung reaksi E2.
Stereokimia
Reaksi E2 terjadi paling cepat ketika ikatan H-C dan ikatan C-LG yang terlibat adalah co-planar, kebanyakan 180o atau antiperiplanar. Hal Ini mengatur ikatan s yang terputus pada posisi yang benar untuk menjadi ikatan p.
Selektivitas
Pengaturan antiperiplanar dalam reaksi E2
Hasil reaksi E2 dikendalikan oleh persyaratan stereokimia yang dijelaskan di atas. Di mana ada pilihan, alkena yang lebih stabil akan menjadi produk utama.
Jalur E2 paling umum dengan:
- konsentrasi tinggi dari basa kuat
- Gugus pergi yang lemah
- R-LG yang tidak akan mempengaruhi kestabilan karbokation (ketika mekanisme E1 akan terjadi).
Contoh khas adalah dehidrohalogenasi alkil halida menggunakan KOtBu / tBuOH.
Permasalahan
Jelaskanlah perbedaan antara reaksi eliminasi dengan substitusi?
Mengapa pada reaksi E2 nukleofil yang digunakan adalah basa bukannya asam?
Mengapa Reaksi Eliminasi 2 (E2) laju reaksi alkil halida tersier lebih cepat dibandingkan yang lainnya?
Sabtu, 09 Februari 2019
Mekanisme Reaksi Subtitusi Nukelofilik SN1
Reaksi SN1
Pada bahasan sebelumnya telah kita pelajari mengenai reaksi
antara alkil halida primer dengan suatu nukelofil yang disebut dengan reaksi
subtitusi nukelofil bimolekular. Lalu pada pada reaksi SN1 ini
terjadi reaksi antara alkil halida tersier dengan suatu nukelofil. Dalam
bahasan kali ini agar lebih mudah dalam memahaminya maka akan digunakan contoh
reaksi antara t-butil bromida dengan
suatu nukelofil berbasa lemah yaitu H2O dan CH3CH2OH
maka akan menghasilkan produk berupa subtitusi sekaligus eliminasi. Kedua
molekul tersebut juga berguna sebagai suatu pelarut oleh karena itu reaksi
subtitusi ini disebut dengan reaksi solvolisis yang mana asal katanya dari solvent dan –lysis yang berarti penguraian oleh pelarut.
Kali ini akan dibahas lebih merinci mengenai produk
subtitusinya. Alkil halida tersier mengalami reaksi SN1 yaitu reaksi
subtitusi nukelofilik unimolekular. Pada reaksi ini enantiomer murni dari suatu
alkil halida yang terdapat ikatan karbon C-X kiral mengalami reaksi SN1
maka akan menghasilkan produk subtitusi rasemik yaitu produk yang bukan inversi,
dan juga berbeda dengan reaksi SN2 yang mana laju reaksi sejalan
dengan konsentrasi nukelofil pada reaksi SN1 pengaruh daripada
konsentrasi itu sendiri sangat kecil.
Mekanisme SN1
Pada mekanisme reaksi SN1 terjadi reaksi antara
molekul pelarut, molekul alkil halida (RX) beserta ion – ion yang terbentuk
oleh karena ni reaksi ini disebut juga reaksi ion. Pada reaksi SN1
memiliki suatu tahapan – tahapan yang sangat kompleks dan perlu dilakukan
sesuai dengan tahapannya.
Pembentukan karbokation adalah hasil dari pematahan alkil
halida menjadi sepasang ion positif (karbokation) dan ion negatif (ion halida).
Pada tahapan ini melibatkan reaksi ion oleh karena itu diperlukan pelarut polar
seperti H2O yang dapat menstabilkan ion, disini H2O juga
berperan sebagai nukelofil karena telah dijelaskan pada bahasan reaksi SN2
sebelumnya bahwasanya pelarut polar juga memiliki pasangan elektron menyendiri
yang nantinya akan membentuk ikatan sigma.
Tahap 2 (penyatuan karbokation dengan nukleofil (H2O))
Pada reaksi kali ini nukleofil yang digunakan yaitu H2O
yang terdiri dari OH- dan H+ yang nantinya OH- akan mengikat
karbokation dan membentuk alkohol bermuatan positif.
Tahap 3 (Pelepasan H+)
Ion H+ pada alkohol bermuatan positif itu akan terlepas guna mencapai kestabilan dalam suatu reaksi asam-basa yang cepat dan tidak dapat kembali dalam keadaan semula dengan pelarutnya.
Kesimpulannya dalan reaksi SN1 terjadi dua reaksi
walaupun dalam tahapannya ada tiga. Reaksi pertama yaitu gabungan antara
ionisasi alkil halida dengan subtitusi nukelofil H2O lalu reaksi
kedua yaitu rekasi asam-basa, agar lebih jelasnya dapat dilihat seperti dibawah
ini
Berikut adalah diagram energi dalam reaksi SN1
Sesuai dengan diagram energi diatas, pada tahap pembentukan karbokation memerlukan energi pengaktifan yang cukup besar, hal ini menyebabkan jalannya reaksi begitu lambat untuk pematahan alkil halida menjadi karbokation dan ion halida.
Karbokation atau bisa disebut dengan “zat-antara”,
zat-antara ini sendiri adalah hasil dari reaksi lebih lanjut didalam struktur
yang bereaksi. Berbeda dengan tahap transisi, zat-antara ini memiliki usia yang
terhingga sedangkan tahap transisi tidak terhingga dan juga dalam tahap
transisi mengalami dua tahapan sekaligus yaitu pematahan dan pembentukan ikatan
baru yang disebabkan oleh melemahnya ikatan halida dengan alkil lalu halangan
sterik yang kecil serta energi aktivasi yang dibutuhkan untuk bereaksi lebih
kecil dari pada energi yang dibutuhkan untuk mencapai tahap transisi yang
mengakibatkan pematahan dan pembentukan ikatan baru terjadi secara spontan, dan
juga energi potensial pada tahap transisi merupakan titik puncak dalam suatu
kurva energi potensial. Hal ini sangat berbeda dengan zat-antara yang mana
merupakan suatu produk yang bersifat reaktif bukannya suatu tahapan. Pada
zat-antara ini juga tidak terjadi pematahan dan pembentukan ikatan. Energi pada
zat-antara pun lebih rendah daripada tahap transisi namun lebih besar dari pada
produk akhir. Pada pembentukan karbokation sendiri pun seperti yang tertera
dalam grafik membentuk suatu lembah sedangkan ketika karbokation sudah
terbentuk akan membentuk suatu bukit yang artinya karbokation itu sendiri
adalah spesi reaktif berenergi-tinggi. Pada tahap subtitusi karbokation dengan
nukelofil membutuhkan energi pengaktifan yang rendah sehingga reaksi terjadi
dengan cepat.
Permasalahan
1. Mengapa didalam reaksi SN1 laju reaksinya hanya menyertakan konsentrasi alkil halidanya saja?
2. Mengapa stabilitas kation metil dan karbokation primer kurang daripada karbokation skunder dan juga karbokation tersier?
3. Karbokation disebut juga dengan zat-antara lalu apa bedanya zat-antara dengan tahap transisi?
2. Mengapa stabilitas kation metil dan karbokation primer kurang daripada karbokation skunder dan juga karbokation tersier?
3. Karbokation disebut juga dengan zat-antara lalu apa bedanya zat-antara dengan tahap transisi?
Langganan:
Komentar (Atom)