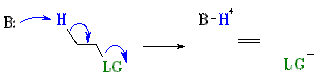E1 menyatakan suatu reaksi eliminasi unimolekular, di mana
laju reaksi = k [R-LG].
Ini menyatakan bahwa langkah penentuan laju reaksi
tergantung pada dekomposisi spesies molekuler tunggal.
Secara keseluruhan, jalur ini adalah proses banyak langkah
dengan dua langkah kritis berikut:
hilangnya gugs pergi, LG, untuk menghasilkan intermediet karbokation, kemudian
kehilangan proton, H +, dari karbokation untuk membentuk
ikatan π
Mari kita lihat bagaimana berbagai komponen reaksi
mempengaruhi jalur reaksi:
R-
Urutan reaktivitas: (CH3)3C-> (CH3)2CH->
CH3CH2-> CH3-
Dalam reaksi E1, langkah penentuan laju adalah hilangnya
gugus pergi membentuk intermediet karbokation. Semakin stabil karbokationnya,
semakin mudah terbentuk, dan semakin mempercepat reaksi E1. Terdapat beberapa
anggapan bahwasanya sistem dengan karbokation yang kurang stabil akan bereaksi
paling cepat, namun pada dasarnya turunan dari karbokationlah yang menentukan
laju reaksi. Karena intermediet karbokation terbentuk selama E1, selalu ada
kemungkinan penataan ulang (mis. 1,2-hidrida atau 1,2-alkil bergeser) untuk
menghasilkan karbokation yang lebih stabil. Ini biasanya ditunjukkan oleh
perubahan posisi alkena atau perubahan kerangka karbon produk bila dibandingkan
dengan substart.
-LG
Satu-satunya peristiwa yang menandakan terjadinya reaksi E1
adalah pemutusan ikatan C-LG. Oleh karena itu, ada ketergantungan yang sangat
kuat pada sifat gugus pergi, semakin baik gugus pergi, semakin cepat pula reaksi
E1. Dalam reaksi alkohol yang dikatalisis oleh asam, -OH diprotonasi terlebih
dahulu untuk memberikan ion oksonium, memberikan gugus pergi yang lebih baik, molekul air (lihat skema di bawah).
B
Karena basa tidak terlibat dalam langkah penentuan laju,
sifat basa tidak penting dalam reaksi E1. Namun, semakin reaktif basa, semakin
besar kemungkinan reaksi E2 menjadi.
Selektivitas
Reaksi E1 akan lebih berjalan dengan baik apabila alkena
yang menjadi produk utama lebih stabil: yaitu lebih tersubstitusi pada alkil
dan trans-> cis-
Jalur mekanisme E1 ini paling umum:
- Gugus pergi yang baik
- karbokation yang stabil
- basis yang lemah
Contoh khasnya adalah dehidrasi asam yang dikatalisisoleh alkohol 2o atau 3o.
MEKANISME E1 PADA ALKOHOL
Langkah 1:
Reaksi asam / basa. Protonasi oksigen yang beralkohol menhasilkan
gugus pergi yang baik. Langkah ini sangat cepat dan dapat dibalik. Pasangan
elektron bebas pada oksigen membuatnya menjadi basa Lewis. Mekanisme E1 untuk
ROH
Langkah 2:
Pembelahan ikatan C-O memungkinkan hilangnya gugus pergi
yang baik, molekul air yang netral, untuk memberikan intermediet karbokation.
Ini adalah langkah penentuan laju (pemutusan ikatan merupakan reaksi endotermik)
Langkah 3:
Reaksi asam / basa. Deprotonasi oleh suatu basa (molekul
air) dari atom C yang berdekatan dengan pusat karbokation mengarah pada pembentukan
C = C
MEKANISME E1 PADAALKIL HALIDA
Langkah 1:
Pembelahan ikatan C-X yang terpolarisasi memungkinkan hilangnya
gugus pergi yang baik, ion halida, untuk intermediet karbokation. Ini adalah
langkah penentuan laju (pemutusan ikatan adalah mekanisme E1 untuk RX)
Langkah 2:
Reaksi asam / basa. Deprotonasi oleh basa (di sini ion
alkoksida) dari atom C yang berdekatan dengan pusat karbokation mengarah pada pembentukan
C = C
Permasalahan :
- Apa perbedaan antara reaksi E1 dan E2?
- Hal apakah yang menyatakan bahwasanya reaksi E1 disebut reaksi eliminasi unimolekuler?
- Apakah mungkin pada reaksi eliminasi E1 dilakukan dalam pelarut non polar?